近日,Nature Communications在线发表了上海交通大学材料科学与工程学院/金属基复合材料国家重点实验室及张江高等研究院李万万研究员、于绪江助理教授团队的“Full-course NIR-II imaging-navigated fractionated photodynamic therapy of bladder tumours with X-ray-activated nanotransducers”研究论文,报道了一种基于Ce3+单中心双敏化机制的纳米闪烁体,该闪烁体在X射线照射下具有可见、近红外二区荧光双重发射,并结合团队所研制新型成像系统,实现了对原位膀胱癌非侵入性荧光成像量化分析及可定制辐射动力学治疗。论文得到了编辑的高度认可,被邀请在Nature Portfolio Communities的“Behind the Paper”栏目撰稿分享研究经历。

膀胱癌是老年人的高发恶性肿瘤,非肌层浸润性膀胱癌(Non-muscle-invasive bladder cancer,NMIBC)占膀胱癌总数的75%以上,常规治疗方法包括手术切除、膀胱镜辅助光动力治疗和大剂量放射治疗。尽管这些疗法效果显著,但NMIBC患者复发或肿瘤进展的风险仍然很高,需要长期随访。因此,自20世纪90年代以来,诊断、治疗和5年生存率一直没有得到很大改善。这主要是由于传统技术未能将实时诊断、同步治疗、体内监测和长期预后结合起来。因此,开发无创和全程成像导航的高效治疗方法是对抗NMIBC的当务之急。
近些年来,“纳米医学”概念的出现,以其创新策略显著提升了癌症治疗的水平。X射线激活的光动力疗法和X射线激活的纳米材料用于近红外-II成像等开创性工作陆续报道。此外,抗肿瘤纳米药物可通过膀胱内灌注的方式在膀胱局部给药,而不是全身系统给药,这将保证临床转化的生物安全性。受此启发,该研究将光医学、X射线和纳米药物结合起来,对NMIBC进行全病程成像和无创治疗。
与之前报道的单一发光的纳米闪烁体结构不同,该研究中设计了具有核-壳-壳结构的纳米闪烁体实现协同敏化的多重发光(图1)。选用了低声子能量的NaGdF4作为闪烁体基质,分别在核心掺杂Ce3+和Tb3+,第一层壳层掺杂Nd3+,最外层NaLuF4层作为惰性层和增敏层,采用热注入法合成具有核壳结构的纳米晶,将掺杂离子空间隔绝以消除交叉弛豫,通过具有f-d跃迁的Ce3+协同敏化Tb3+和Nd3+双重发光中心,实现了在X射线激发下可见/近红外二区双重发光。结果表明,通过引入Ce3+后,可见和近红外二区(NIR-II)放射发光分别提升2.2和12倍;
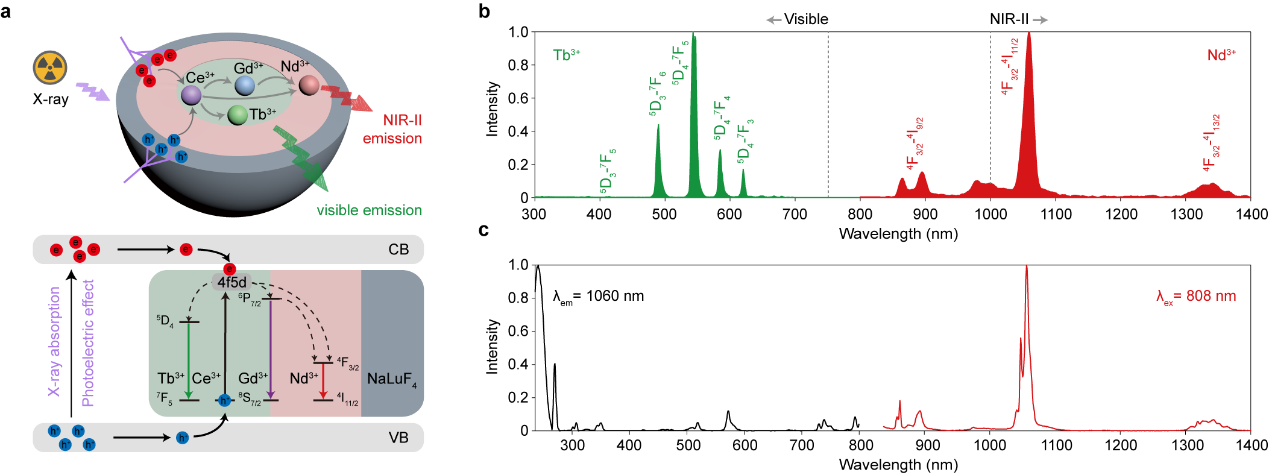
图1. 纳米闪烁体协同敏化机制示意图和X射线及808 nm激光辐照下光谱图
通过在纳米闪烁体表面功能化修饰光敏剂孟加拉玫瑰红(Rose Bengal,RB)和靶向多肽cRGD,构建了纳米诊疗探针,实现了活性氧产生和提升探针的肿瘤富集效率的目的。该研究中使用N-亚硝基-N-甲基脲(MNU)药物诱导建立自发膀胱癌小鼠模型,通过对小鼠膀胱组织进行H&E染色病理分析显示出在小鼠膀胱内出现明显的乳头状肿瘤组织,证实了动物模型的成功建立(图2)。为了证实cRGD修饰的纳米诊疗探针可以特异性靶向肿瘤组织,将cRGD修饰的纳米诊疗探针分别灌注到健康小鼠和患癌小鼠膀胱内,同时设置无cRGD修饰的探针灌注到患癌小鼠膀胱内作为对照,分别进行了离体膀胱组织的NIR-II成像和冷冻切片分析,结果表明cRGD靶向多肽显著增加了纳米诊疗探针在肿瘤组织的富集效率。
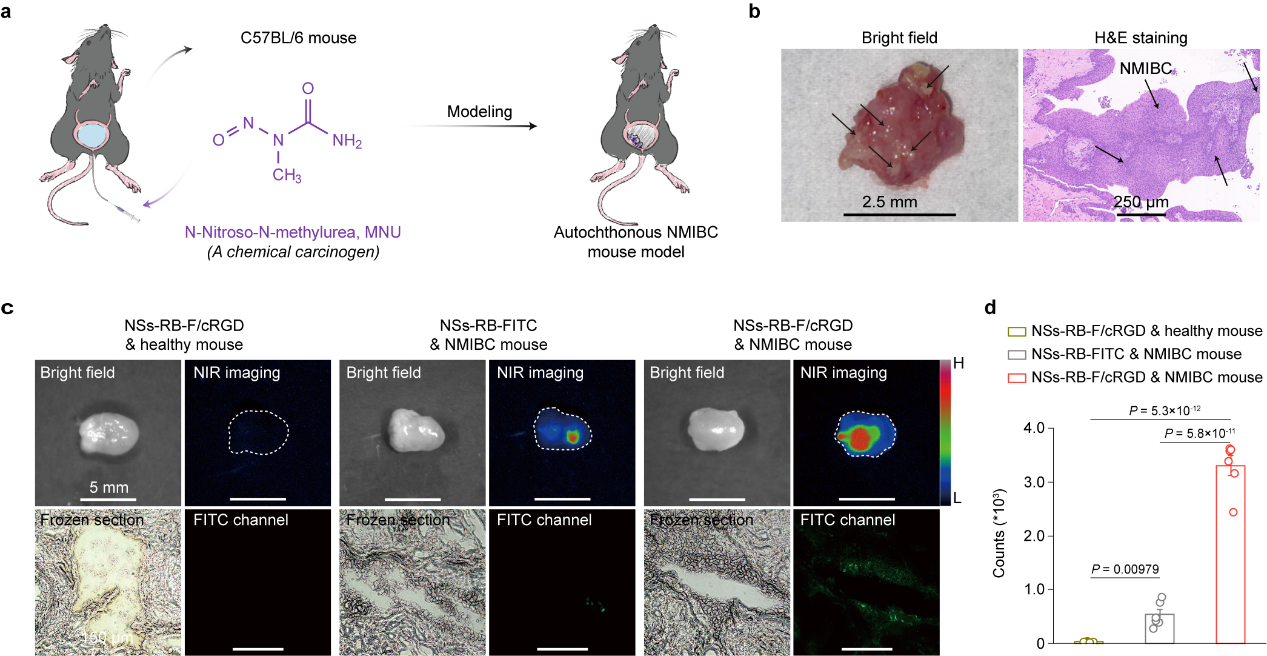
图2 药物诱导的膀胱癌小鼠模型建立及纳米诊疗探针在肿瘤处特异性富集
在建立自发膀胱癌小鼠模型后,将纳米诊疗探针灌注到膀胱内,单次辐照剂量为6Gy的X射线辐照治疗后,并且每周一次,共五次重复进行活体NIR-II成像对病情进行监测。通过监测小鼠21天和56天生存率,结合H&E染色和免疫组化分析,证实了单次X射线治疗后可以消除肿瘤、提升生存率、恢复免疫平衡和抑制肿瘤复发,并且结合NIR-II成像可以实现术后肿瘤的原位评估(图3)。
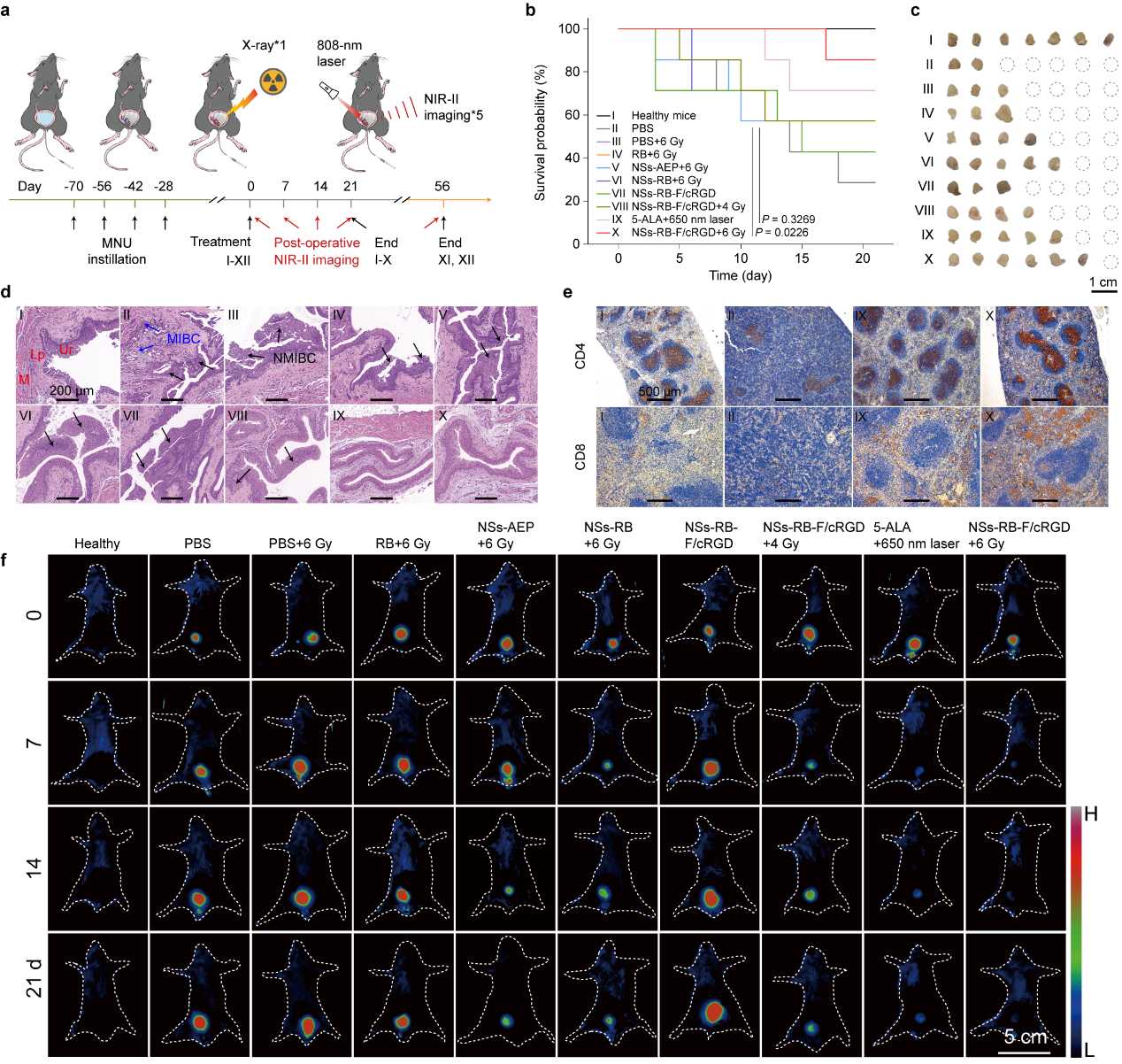
图3 单次X射线激活的光动力治疗后有效的肿瘤消除能力
研究团队进一步研制了具有多重光源激发的快速近红外光子计数系统,实现了对成像的信背比的快速定量分析,从而可实时调整辐射剂量(图4)。通过设置两个不同辐射实验组(G1和G2)。G1和G2组初始给予3 Gy和1Gy剂量,后续根据成像的信背比再给予不同的辐射剂量,G1组56天的生存率为100%,G2组生存率为80%,预示着不同辐射方案对小鼠肿瘤治疗的差异和生存率的影响。结合小鼠膀胱和脾脏H&E染色结果和免疫组化结果,证实了NIR-II成像引导的全病程分割光动力疗法可以实现膀胱癌的术前、术中和术后的监测和决策。
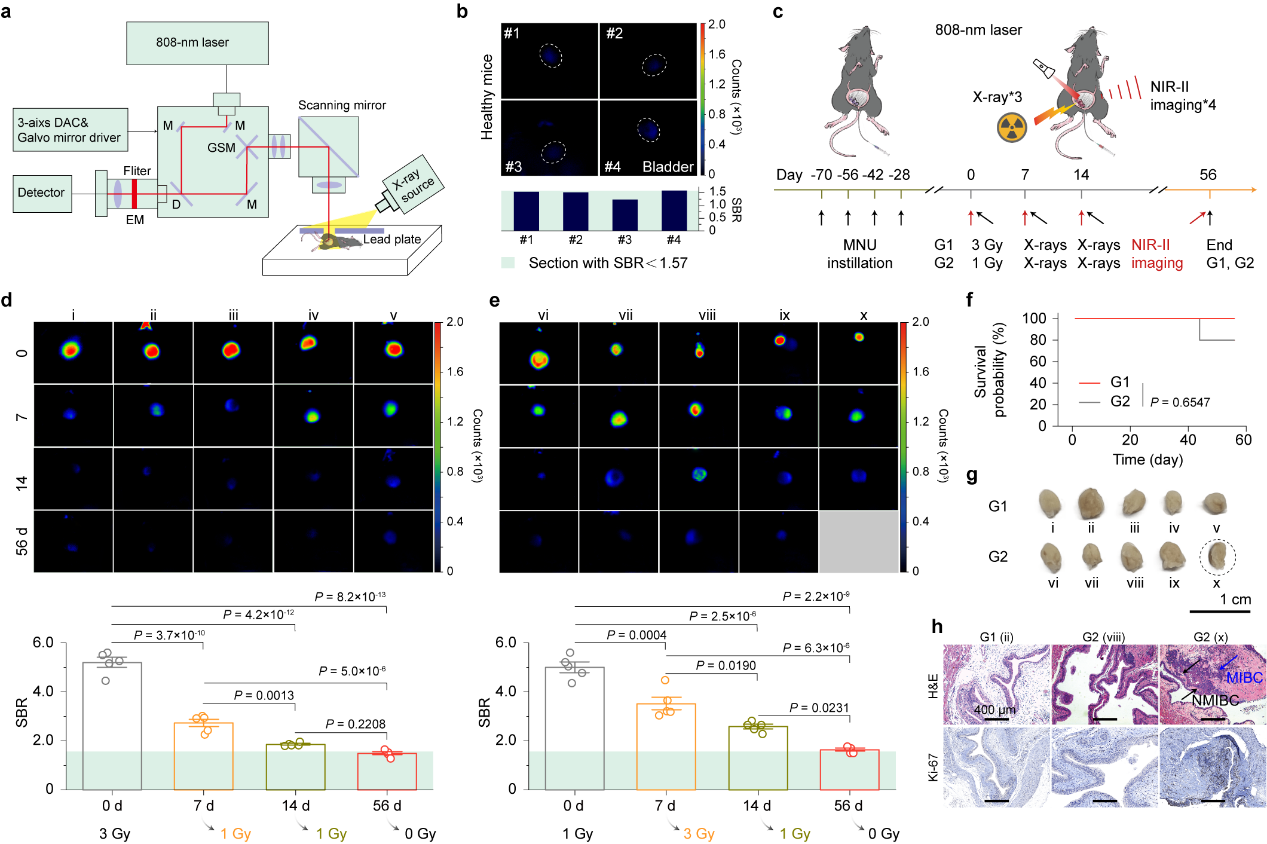
图4 全程的实时近红外-II成像实现了按需分割光动力治疗
该研究聚焦当前缺乏X射线激发近红外成像的纳米闪烁体的缺乏,到膀胱癌诊断、治疗及预后困境等,发展了一种前景广阔的纳米探针和无创全程成像导航的按需治疗策略,具有重要科学价值。
上海交通大学材料科学与工程学院博士生何良锐和上海交通大学医学院附属仁济医院泌尿科博士生王黎阳为论文的共同第一作者,上海交通大学材料科学与工程学院李万万研究员和于绪江助理教授,上海交通大学医学院附属仁济医院泌尿科杨国良副主任医师和苏州大学功能纳米与软物质研究院(FUNSOM)刘庄教授为论文的共同通讯作者。该研究得到了国家自然科学基金(82372089,82272823,82273288)、国家重点研发计划(2017YFA0205304)、国家转化医学设施(上海)转化医学研究基金(TMSK-2021-117)和上海市自然科学基金(23ZR1434600)的资助。
论文链接:https://www.nature.com/articles/s41467-024-52607-9
“Behind the Paper”栏目研究经历链接:https://communities.springernature.com/posts/a-promising-nanotechnology-to-unlocking-bladder-cancer-treatment
作者:何良锐
供稿单位:材料科学与工程学院
